Necrosis avascular cabeza femoral
Introducción y definición
La necrosis avascular (también llamada osteonecrosis, necrosis isquémica o aséptica) se produce por la pérdida temporal o permanente del flujo sanguíneo óseo. En la cabeza femoral, esta interrupción puede ser extraósea (por lesión de las arterias retinaculares tras traumatismo) o intraósea (en casos idiopáticos). La consecuencia final es la necrosis del hueso trabecular, que suele conducir al colapso articular.
Afecta a ambos sexos y puede presentarse a cualquier edad, siendo más común entre los 30 y 40 años. Su impacto funcional es alto, sobre todo en personas jóvenes, que se ven obligadas a modificar su trabajo y estilo de vida. Aunque el objetivo terapéutico principal es conservar la cabeza femoral, esto resulta complejo debido a la variedad de causas, la asociación con otras enfermedades y el desconocimiento de su evolución natural. La osteonecrosis representa entre el 5 y el 12 % de todas las artroplastias de cadera.
Etiopatogenia y factores de riesgo
La necrosis isquémica de la cabeza femoral puede clasificarse en dos grandes grupos: las necrosis postraumáticas (por interrupción macrovascular) y las necrosis idiopáticas (de patogenia no claramente definida, posiblemente por alteraciones microvasculares). En ambos casos, sólo una minoría de pacientes con factores predisponentes desarrolla osteonecrosis, lo que ha llevado a investigar causas genéticas como estados de hipercoagulabilidad y microtrombosis desencadenadas por factores ambientales.
Necrosis postraumática
El trauma es la causa más frecuente de necrosis avascular, que puede iniciarse en pocas horas tras la interrupción del flujo sanguíneo.
Necrosis post-fractura cervical
Provocada por la interrupción de los vasos retinaculares posteriores tras fracturas desplazadas del cuello femoral. La isquemia suele desarrollarse de forma progresiva, y puede manifestarse hasta una década después. Su prevalencia varía del 15 % al 50 % según el tipo y manejo de la fractura.
Necrosis post-luxación de cadera
Se presenta en el 10–25 % de los casos, con mayor riesgo en luxaciones que superan las 12 horas sin reducción. Las luxaciones posteriores y aquellas asociadas a fracturas presentan mayor riesgo isquémico.
Necrosis idiopática
Teorías patogénicas
1. Factores arteriales extraóseos: incluyen lesiones traumáticas o procesos como vasculitis o vasoespasmo que alteran el flujo en las arterias retinaculares laterales. La escasa circulación colateral de la cabeza femoral aumenta el riesgo.
2. Factores arteriales intraóseos: microembolias bloquean la microcirculación, afectando principalmente a epífisis con circulación terminal. Se relaciona con anemia falciforme, alcoholismo, esteroides, hiperuricemia o embolia grasa.
3. Factores celulares citotóxicos: como la radiación, que daña directamente las células óseas.
4. Factores venosos intraóseos: dificultan el retorno venoso y contribuyen a la isquemia.
5. Factores intraóseos extravasculares: el hueso subcondral rígido es vulnerable al aumento de presión (síndrome compartimental). Espasmos o acumulación de materiales intersticiales pueden obstruir la circulación.
6. Factores capsulares: procesos articulares como traumatismos o artritis aumentan la presión intracapsular, reduciendo el flujo epifisario.
Procesos patógenos asociados a necrosis avascular
Alcoholismo
El alcohol tiene efectos tóxicos sobre las células osteogénicas y favorece la formación de hígado graso, que genera embolias grasas. Estas se hidrolizan en ácidos grasos libres, tóxicos para el endotelio vascular. Ingestas >40 ml/semana aumentan 11 veces el riesgo de osteonecrosis.
Uso de esteroides
Producen embolias grasas, aumento de presión intraósea, inhibición de la angiogénesis, toxicidad celular directa, y conversión de médula hematopoyética a grasa. El riesgo es mayor con dosis altas en corto plazo. Puede aparecer años después y conlleva mayor riesgo de colapso óseo.
Enfermedad por descompresión
En buzos o trabajadores expuestos a hiperbarismo. Las burbujas de nitrógeno obstruyen capilares. Factores de riesgo: profundidad, número de inmersiones, edad, obesidad, hiperlipidemia.
Enfermedad metastásica
Las células tumorales aumentan la presión intramedular y obstruyen vasos. El riesgo crece con esteroides o radioterapia en la cadera.
Pancreatitis
Las enzimas pancreáticas liberan ácidos grasos libres, tóxicos para el endotelio vascular, favoreciendo la coagulación y necrosis.
Hemoglobinopatías falciformes
La drepanocitosis provoca hiperviscosidad y oclusión de vasos pequeños. Es una causa común en África y genera infartos extensos.
Enfermedad de Gaucher
El acúmulo de glucocerebrósidos en médula ósea aumenta la presión y obstruye sinusoides, provocando infartos óseos.
Diálisis
El hiperparatiroidismo secundario desorganiza la matriz ósea, genera microfracturas y eleva la presión intramedular.
Radioterapia
Produce fibrosis y arteritis. Si se combina con esteroides o quimio, el riesgo aumenta. Aparece con dosis superiores a 30 Gy.
Hiperuricemia
Se asocia a factores como alcoholismo, obesidad, sedentarismo o pancreatitis. Se han encontrado cristales de urato en vasos perinecróticos.
Hemofilia
Las microhemorragias aumentan la presión intraósea. Las hemorragias articulares comprimen vasos retinaculares, agravando la isquemia.
Estados de hipercoagulabilidad
Deficiencias en proteínas anticoagulantes o trastornos fibrinolíticos generan microtrombosis. La hiperfibrinogenemia provoca hiperviscosidad y disminución del flujo sanguíneo. Se asocia a hiperlipidemia, tabaquismo, diabetes y anticonceptivos.
Hipercoagulabilidad adquirida
El riesgo trombótico se incrementa cuando factores genéticos se combinan con adquiridos.
Otras causas destacadas:
- Legg-Calvé-Perthes (más común en niños)
- Epifisiolisis femoral proximal
- Luxación congénita de cadera
- Hígado graso
- Fractura del cuello femoral
- Anemia falciforme
- Embarazo
Clínica
El cuadro clínico de la necrosis avascular de la cabeza femoral varía según la etapa de evolución de la enfermedad. En las fases iniciales puede ser asintomática, lo que retrasa el diagnóstico. A medida que progresa, el síntoma más característico es el dolor en la región inguinal, que puede irradiarse hacia la cara anterior del muslo, la nalga o la rodilla homolateral. Este dolor suele ser insidioso, de tipo mecánico, agravado por la carga y la marcha prolongada, y mejora con el reposo.
En etapas más avanzadas, el dolor puede volverse continuo, incluso en reposo o durante la noche, y asociarse a rigidez matutina, cojera o limitación progresiva del rango de movilidad, en especial de la rotación interna y la abducción. En algunos casos, los pacientes presentan atrofia del cuádriceps o del glúteo medio por desuso.
En necrosis bilaterales (presentes en hasta el 50 % de los casos), los síntomas pueden ser simultáneos o diferidos entre ambas caderas. En casos secundarios a tratamiento con corticoides o alcoholismo crónico, es común que la necrosis pase desapercibida hasta fases más avanzadas.
Diagnóstico
El diagnóstico de la necrosis avascular de la cabeza femoral se basa en la combinación de la sospecha clínica, estudios de imagen y, en algunos casos, pruebas complementarias. Las radiografías simples anteroposteriores y en perfil de la pelvis y la cadera son la primera herramienta diagnóstica, aunque en fases precoces pueden ser normales.
La resonancia magnética (RM) es el método más sensible y específico para detectar la necrosis en estadios iniciales. Permite identificar cambios precoces en el hueso trabecular, edema óseo y zonas de necrosis antes de que sean visibles en radiografías. El signo más característico en RM es el "doble anillo", una línea hipointensa periférica rodeando una zona hiperintensa, que representa el tejido necrótico y la reacción reparativa.
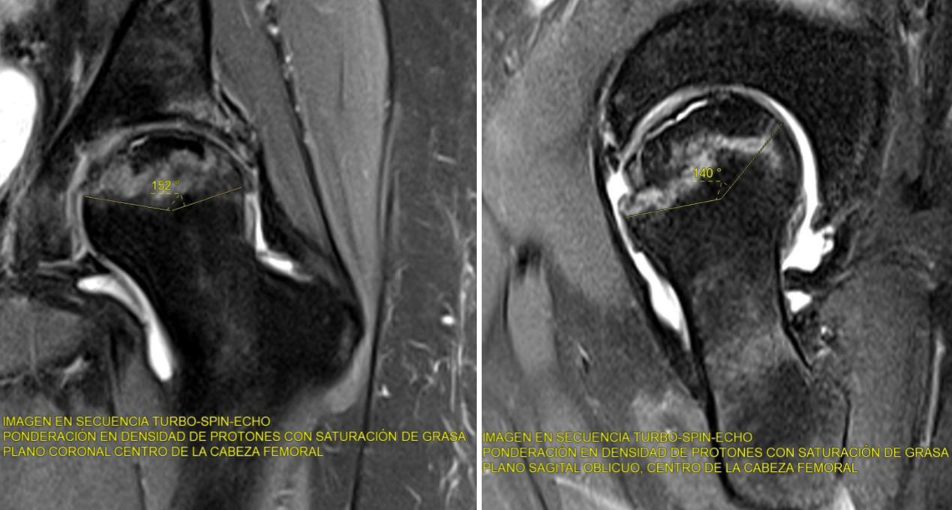
La gammagrafía ósea con tecnecio-99 puede detectar hipocaptación en las fases iniciales, aunque es menos específica que la RM. También se emplea la tomografía computarizada (TC) para valorar el grado de colapso y la morfología de la cabeza femoral en fases avanzadas.
En algunos casos puede realizarse una biopsia ósea para confirmar el diagnóstico histológico, especialmente en casos atípicos o cuando se requieren datos de investigación.
El diagnóstico debe completarse con la clasificación del estadio de la necrosis mediante alguno de los sistemas disponibles (Ficat y Arlet, Steinberg, ARCO), lo cual es fundamental para planificar el tratamiento adecuado.
Clasificación
La osteonecrosis de la cabeza femoral se clasifica radiológicamente para evaluar la progresión de la enfermedad. La primera clasificación, de Ficat y Arlet, se basó en radiografías simples, lo que la hacía menos útil en las etapas iniciales, cuando los cambios solo son visibles con estudios más sensibles.
Con el avance de la tecnología, surgieron clasificaciones más completas que incorporaron la resonancia magnética (RM), como la de la Universidad de Pensilvania (Steinberg) y la de la Asociación de Investigación de la Cadera (ARCO). Ambas han refinado la forma de evaluar la enfermedad al incluir el tamaño de la lesión y ser más precisas, lo que es fundamental para decidir el tratamiento. La clasificación ARCO es actualmente la más utilizada por su exhaustividad, pero la de Steinberg sigue siendo una herramienta muy valiosa.
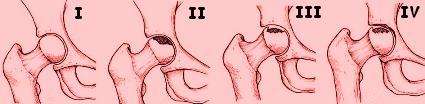
1. Clasificación de Ficat y Arlet
Se basa principalmente en radiografías simples.
- Estadio I: Las radiografías son normales. El diagnóstico se hace por RM o gammagrafía ósea, que muestran alteraciones.
- Estadio II: Hay cambios en la cabeza femoral como esclerosis (zonas más densas) y quistes, pero la forma de la cabeza aún es esférica. No hay colapso subcondral.
- Estadio III: Se observa una fractura subcondral, conocida como el "signo de la luna creciente", pero la cabeza femoral mantiene su forma redondeada sin aplanamiento significativo.
- Estadio IV: Hay colapso y aplanamiento de la cabeza femoral, con estrechamiento del espacio articular y signos de artrosis.
2. Clasificación de la Universidad de Pensilvania (Steinberg)
Es una versión más detallada que integra hallazgos radiográficos, de RM y de gammagrafía, y también clasifica la lesión según su tamaño.
- Estadio 0: La radiografía y la RM son normales, pero existe evidencia histológica de necrosis (se confirma por biopsia).
- Estadio I: La radiografía es normal, pero la RM o la gammagrafía ósea son anormales.
- Estadio II: Se observan cambios como esclerosis o quistes en la radiografía, pero sin colapso.
- Estadio III: Aparece el "signo de la luna creciente" (fractura subcondral) sin aplanamiento de la cabeza femoral.
- Estadio IV: Hay aplanamiento de la cabeza femoral.
- Estadio V: Se observa estrechamiento del espacio articular y cambios degenerativos en el acetábulo.
- Estadio VI: La enfermedad ha progresado a una artrosis avanzada.
Nota: Los estadios del I al IV se subdividen con las letras A, B y C para indicar el tamaño de la lesión (leve, moderada, grave).
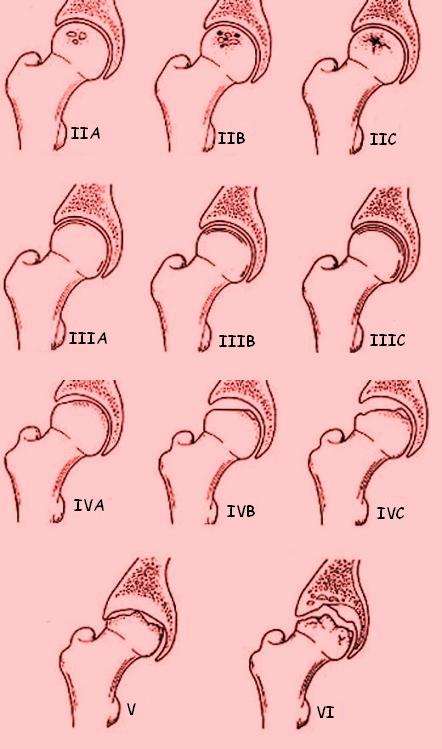
3. Clasificación de la Asociación de Investigación de la Cadera (ARCO)
Es la clasificación más completa y reciente, que integra todas las modalidades de imagen y los hallazgos de las clasificaciones anteriores.
- Estadio 0: No hay síntomas ni hallazgos en radiografía o RM.
- Estadio I: La radiografía es normal, pero la RM o la gammagrafía ósea muestran la lesión.
- Estadio II: Se ven cambios radiográficos (esclerosis, quistes), pero no hay colapso subcondral.
- Estadio III: Se observa la fractura subcondral ("signo de la luna creciente") con una depresión superficial, pero la cabeza aún no está deformada.
- Estadio IV: La cabeza femoral se ha aplanado y se han producido cambios artrósicos en la articulación, con estrechamiento del espacio articular.
Nota: Al igual que en la clasificación de Steinberg, los estadios intermedios de ARCO se subdividen para indicar el tamaño y la gravedad de la lesión, lo que ayuda a una mejor planificación del tratamiento.
Tratamiento
El tratamiento depende del estadio evolutivo, extensión de la isquemia, edad y situación funcional del paciente. También influyen factores como el nivel de actividad, la tolerancia al dolor, la colaboración y la bilateralidad. En ocasiones, puede haber destrucción radiológica importante con buena tolerancia funcional.
La tendencia actual es conservar la cabeza femoral en estadios iniciales, especialmente en pacientes jóvenes, para evitar la necesidad precoz de prótesis articulares, que se reservan para casos avanzados o discapacitantes.
Tratamiento no quirúrgico
Tiene un pronóstico limitado. La descarga no suele evitar el colapso, salvo en lesiones localizadas. En estadios I a III, las tasas de éxito oscilan entre el 13 % y el 35 % según Mont y Hungerford.
Tratamiento quirúrgico
Descompresión del núcleo
Es el tratamiento más habitual en fases iniciales. Aunque ampliamente utilizado, no hay consenso sobre técnica ni indicaciones. Mont y Hungerford reportaron éxito del 84 % (estadio I) y 65 % (estadio II). Steinverg halló mejores resultados con afectación menor del 30 %.
Injertos osteomusculares
Aunque conceptualmente adecuados, los injertos pediculados no ofrecen vascularización ni capacidad osteogénica suficientes para prevenir secuelas como colapso o coxartrosis.
Injerto óseo no vascularizado
La técnica de Phemister, basada en eliminar tejido necrótico para permitir revascularización, ha caído en desuso por su baja eficacia. Solo se recomienda en casos muy precoces y seleccionados.
Injertos libres vascularizados de peroné
Ofrecen buena revascularización y soporte estructural, indicados en menores de 50 años sin colapso. Tienen complicaciones en el 19 % de los casos y se desaconsejan en mayores de 40 años con afectación extensa.
Osteotomías
Permiten desviar la carga del segmento necrótico y reducir la hipertensión venosa, pero sus resultados son variables. No son tratamiento estándar y dificultan futuras prótesis.
Resuperficialización femoral
Indicado en pacientes jóvenes con afectación extensa pero sin degeneración acetabular. Conserva hueso y facilita futura artroplastia total. Su eficacia es menor que esta última, especialmente en mayores de 50 años.
Prótesis totales
Son la opción más eficaz para aliviar el dolor y restaurar la función en casos avanzados, aunque sacrifican más hueso y limitan tratamientos futuros. Indicadas en:
- Osteonecrosis con cambios degenerativos severos.
- Pacientes mayores o con afectación extensa y dolor significativo.
Contraindicadas en:
- Casos precoces con opciones conservadoras viables.
- Pacientes con alto riesgo quirúrgico (e.g., alcoholismo grave).
En pacientes intermedios, puede considerarse junto a otras opciones como la hemiartroplastia de revestimiento. Ofrece alivio predecible del dolor y mejora funcional.
Conclusiones
La necrosis avascular de la cabeza femoral constituye una patología compleja cuya evolución y tratamiento dependen de múltiples factores: estadio radiológico, extensión de la lesión, etiología, edad y nivel funcional del paciente. A pesar de los avances diagnósticos y terapéuticos, sigue siendo un reto clínico importante, especialmente en pacientes jóvenes, en quienes el objetivo prioritario debe ser la preservación de la cabeza femoral.
Las opciones terapéuticas deben individualizarse cuidadosamente, valorando el balance entre tratamientos conservadores y quirúrgicos. En estadios precoces, los procedimientos de preservación como la descompresión del núcleo o los injertos vascularizados pueden ser eficaces en casos seleccionados. Sin embargo, en fases avanzadas o con colapso estructural, la artroplastia total continúa siendo el tratamiento más efectivo para aliviar el dolor y mejorar la calidad de vida.
El seguimiento clínico y radiológico es fundamental para adaptar la estrategia terapéutica al curso evolutivo de la enfermedad. A largo plazo, se necesitan estudios que mejoren la comprensión de los mecanismos patogénicos, optimicen la selección de pacientes y definan los criterios de éxito para cada intervención.